«El enemigo de mi enemigo es mi amigo». La salud pública mundial se enfrenta a un problema creciente: las llamadas superbacterias, o bacterias multirresistentes a los antibióticos conocidos. Pero las bacterias tienen depredadores naturales, los virus que infectan y destruyen células procariotas, llamados bacteriófagos o ‘fagos’. Y muchos científicos se plantean usarlos como terapia contra las superbacterias.
Hablamos con una experta. Pilar Domingo-Calap es investigadora del Instituto de Biología Integrativa de Sistemas, (I²SysBio), centro mixto de investigación entre la Universitat de València y el CSIC. Y también pertenece a FAGOMA, la Red Española de Bacteriófagos y Elementos Transductores.
.
Las infecciones por bacterias multirresistentes o panresistentes a antibióticos causan 1,2 millones de muertes, cada año, en todo el mundo. Matan más que el sida, la malaria y algunos tumores. ¿Es así?
Efectivamente, esa cifra que das es de un estudio reciente de The Lancet, que es una de las revistas más prestigiosas en medicina. El estudio, que se hizo en 2019, antes de la pandemia, habla de 1,2 millones de muertes atribuibles directamente a estas infecciones por bacterias resistentes a antibióticos, y hasta 5 millones si consideramos las muertes asociadas a bacterias. Son datos terribles, y estoy segura de que los estudios que se hagan después de la pandemia -del 2020, 2021- van a dar cifras aún mayores. Porque mucha gente que ha sido hospitalizada en UCI por Covid, han contraído infecciones nosocomiales, enfermedades secundarias provocadas por bacterias multirresistentes. De hecho, se estima que la mitad de pacientes con Covid que han muerto en las UCI, lo han hecho por estas bacterias nosocomiales, resistentes a los antibióticos, que se alojan en catéteres, respiradores, etc… Estas superbacterias son como una pandemia silenciosa.
Estas superbacterias son un problema de salud pública que sabemos que va a ir a más por el uso generalizado, y muchas veces abusivo, de los antibióticos.
Exacto. Y ese uso abusivo no sólo se ha dado en medicina o para tratar enfermedades humanas, que por supuesto, sino que se da también en agricultura y ganadería. Durante muchísimos años se han estado usando toneladas de antibióticos en las granjas, que han generado bacterias superresistentes que luego han pasado a todos los ecosistemas. Y luego esos genes de resistencias a antibióticos pueden pasar de una bacteria a otra, incluso de una especie bacteriana a otra. Con lo cual un gen de resistencia a un antibiótico que se ha generado en una bacteria que ataca a las plantas, o a otro animal, puede acabar llegando a una bacteria patógena para los humanos.
Las superbacterias son una pandemia silenciosa.
En este contexto, hay toda una corriente de investigadores que se esfuerza en los virus bacteriófagos o ‘fagos’ como un arma terapéutica. Recientemente se ha hecho famoso el caso de un paciente en EEUU que estaba prácticamente al borde de la muerte por la infección de una superbacteria, que sanó en muy poco tiempo al serle aplicado un fago. ¿Cómo de avanzada está este tipo de terapias con fagos?

En esta parte del mundo, esta terapia está por desarrollar, y eso que los virus bacteriófagos se descubrieron hace un siglo, sobre 1917. Sin embargo en otros países: en Rusia, Georgia o Polonia, este tipo de terapias son rutinarias, se llevan aplicando durante décadas, y se siguen usando. Pero en el resto de Occidente, en el resto de la UE o América, lo que ha pasado es que al tener acceso a los antibióticos se abandonó la terapia fágica muy pronto. Hasta ahora nos ha parecido muy cómodo usar unas drogas como los antibióticos de amplio espectro, que eliminan gran cantidad de bacterias y no necesitas saber cuál es la que está produciendo la infección. Pero claro, el uso indiscriminado de antibióticos ha acabado generando resistencias, y bacterias multirresistentes o panrresistentes a todos los antibióticos conocidos.
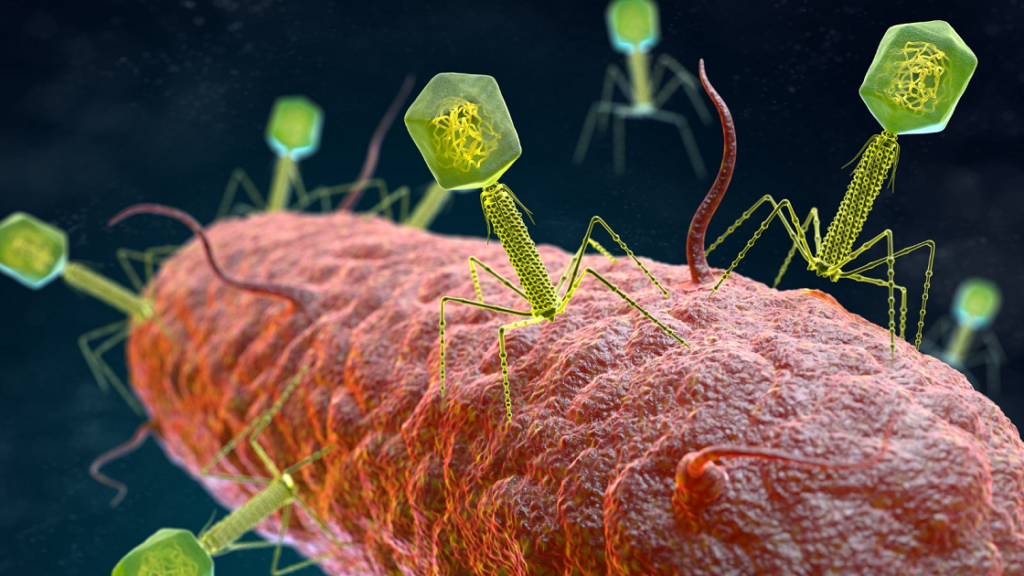
Entonces ha surgido la necesidad de tratamientos alternativos y ha vuelto la idea de usar fagos como arma terapéutica. Y esos virus ya están en la naturaleza, en una enorme cantidad. Se estima que por cada especie bacteriana hay al menos 10 virus bacteriófagos capaces de infectarla. Y al haber tantos fagos, podemos encontrar y aislar virus que infecten de forma muy específica a esa especie bacteriana, sin eliminar al resto que son beneficiosas. Son armas, armas biológicas, enormemente específicas y superpotentes, porque además su efecto se autoamplifica: al infectar a la bacteria los fagos se replican, generando copias de sí mismos, que vuelven a atacar a más bacterias diana.
¿Como está esta terapia de avanzada? Pues vamos muy lentos, porque a nivel europeo no están autorizados como tratamiento convencional, y sólo está autorizado su uso compasivo. Lo mismo pasa en EEUU, que su uso es compasivo. Sin embargo, la FDA autorizó el año pasado el tratamiento preventivo con fagos para casos de pacientes Covid en UCI, por lo queen EEUU los pacientes con Covid que ingresan en UCI pueden elegir esta terapia fágica.
En algunos países, especialmente en el este de Europa, las terapias fágicas son rutinarias
¿El objetivo es ir dotándose de una librería de fagos especializados contra cada tipo de superbacteria, llegar a tener un arsenal de varios fagos para cada bacteria superresistente?
Claro, esa es la idea. Estamos trabajando en tener esas colecciones de fagos, esas librerías. Mi idea es que cuando las tengamos, estén disponibles para cualquier médico, cualquier paciente, de cualquier parte del mundo. Queremos tener una librería de fagos como las colecciones tipo de bacterias, con los virus preparados y caracterizados, para que en el momento que un paciente tenga una infección con estas bacterias superresistentes, podamos usarlos. También poder crear cócteles de fagos para ciertas bacterias, o tener fagos de amplio espectro que pueden eliminar varios tipos de cepas, o de especies de bacterias, a la vez.
A día de hoy, como no tenemos esta librería, el proceso es al revés. Tenemos un paciente con una infección con una bacteria multirresistente, aislamos esa bacteria, y buscamos entre los pocos fagos que tenemos aislados y caracterizados, a ver si hay alguno que puede atacarla. O si no lo hay, buscamos nuevos fagos, pero eso es un proceso complicado y largo: hay que hallarlo, aislarlo, caracterizarlo, y luego producirlo en una escala que podamos usarlo como terapia. Eso lleva tiempo, y por eso el tipo de pacientes que se pueden tratar son los que tienen una enfermedad bacteriana multirresistente pero que es crónica. Por ejemplo, los pacientes con fibrosis quística que presentan infecciones por Pseudomonas, o Mycobacterium. En el caso de infecciones agudas, de vida o muerte, el no tener estas librerías nos deja pocas opciones y tiempo para actuar. Y de ahí la importancia de dotarnos de esas grandes colecciones de fagos listas para poder usarse inmediatamente.
Esto, como yo lo veo, va hacia una medicina personalizada. Donde se estudia qué bacteria y qué cepa está atacando a cada paciente, y ver qué fago es el idóneo para combatirla.
Cada tipo de fago ataca de forma muy específica a un tipo de bacterias, y nunca podrían infectar las células humanas, pero al mismo tiempo estos virus tienen complejas interacciones con nuestro sistema inmune. ¿Qué ventajas e inconvenientes tiene usar un agente biológico -un virus bacteriófago- frente a un agente químico -un antibiótico- contra una bacteria?
Pues hay muchas ventajas y también desventajas. En cuanto a lo que dices de las relaciones de estos virus con nuestro sistema inmune, la realidad es que nuestro cuerpo ya está conviviendo con ellos constantemente. Cada ser humano tiene en la flora de su piel, de sus mucosas, de su intestino, billones de bacterias. Y junto a ellas están, de forma natural, los fagos que las depredan y que mantienen en equilibrio estas poblaciones de la microbiota. Tenemos 39 billones de bacterias en nuestro cuerpo, y diez veces más fagos. Hasta el punto que el 30% de las proteínas codificadas por el metagenoma del intestino humano son de origen fágico.
Y por eso la mayoría de los estudios postulan que nuestro sistema inmunológico no reconoce a esos fagos como algo ajeno, como algo contra lo que tenga que reaccionar. En el caso del paciente de EEUU tratado con fagos contra Mycobacterium chelonae, sí se detectó la producción de anticuerpos contra el fago, que se administró por vía intravenosa, pero no los suficientes como para bloquearlo. Se produjo una respuesta inmune basal que no afectó al tratamiento.
Por el lado contrario, sí se ha visto que a veces, cuando se usan fagos contra una infección bacteriana que está muy localizada en un órgano o tejido, las bacterias destruidas por esos fagos producen endotoxinas que «llaman» al sistema inmune, guiándolo hacia la infección.
Y hay muchas más ventajas. Porque un antibiótico es una molécula química estable. Una vez que la bacteria logra ser resistente, ya no sirve. Pero un virus puede coevolucionar con su víctima, la bacteria. La bacteria puede desarrollar resistencia al virus que la depreda, pero entonces empieza la típica carrera armamentística entre depredador y presa de la evolución, y al final surge una nueva cepa de fagos que logra atacar a la bacteria invulnerable.
Y en esta coevolución entre el virus y la bacteria, se puede producir una sinergia entre la actuación de los fagos y los antibióticos. Porque se han visto muchos casos de que la bacteria multirresistente a antibióticos, al mutar y volverse resistente al fago que la ataca… vuelve a ser vulnerable a un antibiótico.
Te pongo un par de ejemplos. Muchas veces la resistencia de una bacteria a un antibiótico consiste en que produce una capa externa, una barrera impermeable, que impide la entrada de este compuesto en la célula. Pero justamente esa capa externa es la que el fago «reconoce», donde están sus receptores para anclarse a la bacteria e infectarla. Así que cuando la bacteria se ve atacada por el fago, deja de producir la barrera impermeable para evitar ser infectada… pero entonces vuelve a ser vulnerable al antibiótico.
El objetivo es tener librerías de fagos listas para ser utilizadas por cualquier médico en todo el mundo
Otras veces, las bacterias son resistentes a los antibióticos porque desarrollan en sus paredes «bombas de eflujo», que bombean este compuesto nocivo de nuevo al exterior de la célula. Pero justamente muchos fagos tienen como diana, como proteína de anclaje, estas bombas de flujo en la membrana bacteriana. Lo mismo que antes. Cuando la bacteria se siente atacada por el virus, inhibe la expresión de estas bombas de membrana… volviendo a ser vulnerable al antibiótico.
De ahí que se usen en estas terapias, los fagos y los antibióticos al mismo tiempo. Porque se produce una sinergia entre los dos. De hecho, este fenómeno se conoce como «Phage-Antibiotic Synergy» o efecto PAS.
Por último, los fagos no sólo pueden ser enormemente efectivos en el combate a las superbacterias, sino para muchas cosas más, como fuente de enzimas con actividad antimicrobiana, o como métodos de detección avanzada de bacterias.
Efectivamente, esto es todo un mundo. Los virus bacteriófagos son las entidades biológicas más abundantes del planeta, se estima que existen 1031 bacteriófagos en la biosfera. Así que imagínate cuántas cosas nos pueden ofrecer todavía. Los fagos ya han sido una herramienta fundamental en el desarrollo de la biología molecular. Porque además nos pueden servir como herramientas de biocontrol de bacterias, no sólo contra tratamiento de infecciones como hemos visto, sino como preventivo. Por ejemplo, pueden servir como desinfectante, para destruir los biofilms o biopelículas que pueden formar bacterias nosocomiales, muy difíciles de eliminar en equipamiento hospitalario como ventiladores, catéteres o prótesis. O también, como son tan específicos, se pueden usar como biosensores, como marcadores para saber qué infección tienes y dónde está localizada. Son el pasado, pero también van a ser el futuro.
Esto pone a la lucha contra las enfermedades bacterianas ante una auténtica revolución. ¿Estamos ante un salto cualitativo en la medicina?
Esto lleva tiempo. Primero necesitamos una regularización y legislación, porque ahora mismo solo se pueden usar de forma compasiva, muy personalizada. Necesitamos poder realizar ensayos clínicos con fagos, poder ver su efectividad en grandes grupos de población. Entonces podremos saber si esto es una revolución.
Necesitamos regularización y financiación
Y luego está el problema de la financiación y de los medios de los que disponemos. Los laboratorios que trabajamos con fagos somos muy poquitos, y requerimos de financiación, medios y personal para poder atender casos de pacientes. Esta semana me han contactado ya cinco pacientes para poder hacer ensayos, y tenemos los medios que tenemos. Con más medios y personal podríamos investigar mucho más y lograr esas librerías de las que hablábamos antes.