Una enfermedad congénita -determinada por un defecto o mutación en los genes- es, por definición, incurable, una condena de por vida. Hasta ahora.
El descubrimiento, en la década pasada, de las herramientas CRISPR-Cas9, ha venido a revolucionar la medicina y abrir paso a las terapias génicas, capaces de editar y reescribir el ADN de nuestras propias células.
Fue un hallazgo casual, del científico alicantino Francis Mojica, cuando investigaba la resistencia a los virus de la arquea halófita Haloferax mediterranei en las salinas de Torrevieja. Observó que estas arqueobacterias podían reescribir su ADN para corregir y ‘borrar’ los genomas víricos que se insertaban en su cromosoma.
Podría haberse quedado como una curiosidad bioquímica, perdida en una investigación básica. Pero hubo quien detectó el gigantesco potencial biotecnológico de las enzimas CRISPR-Cas9. Las científicas Emmanuelle Charpentier y Jennifer Doudna aislaron estas proteínas y las pusieron a punto como herramientas de edición genética, abriendo un abanico de posibilidades casi infinito para la biología molecular y la medicina.
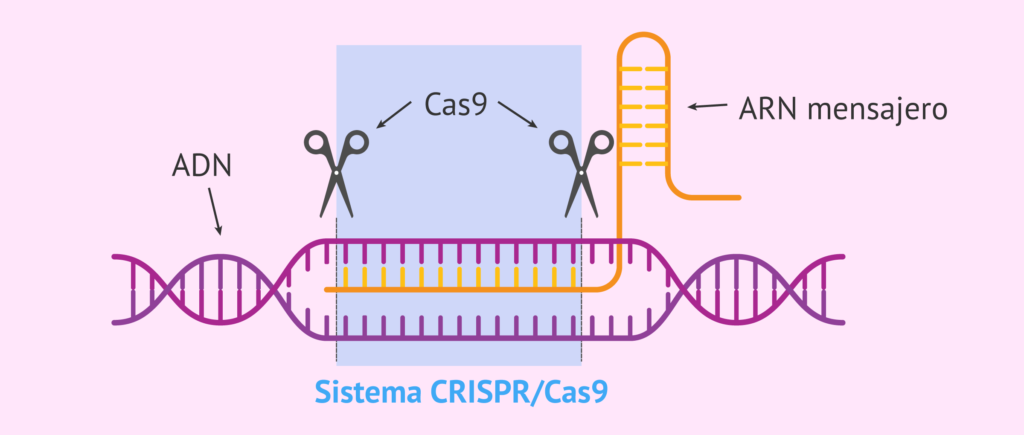
La revolución CRISPR permite regular la expresión de los genes en células vivas, etiquetar e identificar sitios específicos del genoma, modificar la función de los genes y “corregir” genes mutados o disfuncionales. Son unas tijeras, un «cortapega» genético.
Y todo ello de manera fácil, rápida, barata, segura y certera, al alcance de cualquier laboratorio. En 2020 les fue otorgado un Premio Nobel de Química más que merecido, aunque en justicia debería haberse incluido a Mojica.
La edición genética ya está aquí
De unos años a esta parte, las terapias génicas y en particular las basadas en las tijeras CRISPR han empezado a dar espectaculares frutos, abriendo la puerta a curar enfermedades genéticas antes incurables, corrigiendo los genes disfuncionales causantes de los trastornos congénitos.
Este es el caso de un tipo de ceguera hereditaria, la amaurosis congénita de Leber, que causa una severa pérdida visual tras el nacimiento. Está causada por la mutación del gen CEP290, que codifica una proteína fundamental para la vista, ya que determina el correcto funcionamiento de los conos y los bastones de la retina. Esta ceguera afecta a 2 o 3 recién nacidos de cada 100.000.
Por primera vez, un equipo del Servicio de Trastornos Hereditarios de Retina del Hospital Mass General Brigham de Boston ha aplicado la tecnología CRISPR para la edición de genes en vivo -es decir, dentro del cuerpo humano- logrando mejorar la visión de un grupo de pacientes de esta ceguera.
El ensayo ha sido bautizado como ‘Brilliance’ («brillantez») y publicado en The New England Journal of Medicine está aún en sus etapas más iniciales, entre las fases 1 y 2 de prueba. Pero sus conclusiones ponen de manifiesto que el tratamiento es “seguro y condujo a progresos demostrados en los pacientes tratados”, subrayan los autores.
De los 14 participantes en el ensayo, entre ellos 12 adultos (de entre 17 y 63 años) y dos niños (de 10 y 14 años), 11 de ellos experimentaron una notable mejora en su visión.
El tratamiento experimental se diseñó específicamente para editar esa mutación en el gen CEP290 y fue suministrado mediante una única inyección en el ojo del medicamento de edición del genoma EDIT-101 gracias a un procedimiento quirúrgico especializado.
Una vez administrado el medicamento, los investigadores midieron su efectividad teniendo en cuenta cuatro parámetros: agudeza visual, prueba de campo completo adaptada a la oscuridad, visión a distancia corregida y calidad de vida relacionada con la vista.
Once de los catorce participantes (un 79%) mejoraron en al menos una de estas características; mientras que 6 pacientes (un 43%), lo hicieron en dos o más. También 6 reportaron una mejora de la calidad de vida relacionada con la visión y 4 (un 29%) presentaron una mejoría clínicamente significativa de la agudeza visual, que se manifiesta, por ejemplo, en la capacidad de identificar objetos o letras en una tabla.
“Uno de los participantes en nuestro ensayo ha compartido varios ejemplos de cómo ha mejorado su calidad de vida gracias a recuperar visión, como haber podido encontrar su móvil tras haberlo extraviado o saber que su cafetera funciona al ver sus pequeñas luces”, apunta uno de los autores, Mark Pennesi, oftalmólogo y científico de la Universidad Estatal de Oregón.
“Escuchar a varios participantes lo emocionados que estaban porque por fin podían ver la comida en sus platos fue muy gratificante, porque se trataba de personas que antes de recibir el tratamiento eran incapaces de leer», afirma Eric Pierce, uno de los autores que trabaja en la Universidad de Harvard y el Hospital Mass General Brigham de Boston. «Merece la pena seguir investigando y realizando ensayos clínicos sobre la terapia génica con CRISPR para la pérdida de visión hereditaria».
Ninguno de los pacientes experimentó ningún efecto adverso grave relacionado con el tratamiento, ni toxicidades limitantes de la dosis y, según informan los investigadores, todas las consecuencias secundarias leves que reportaron han sido ya resueltas.
Un centenar de investigaciones con las tijeras CRISPR
El ensayo Brilliance es el primero que se dirige a curar la ceguera congénita, pero hay otras muchas investigaciones que ya están usando las tijeras CRISPR para modificar in vivo otros trastornos genéticos.
En 2021 la edición CRISPR se usó en el hígado de varios pacientes para corregir la amiloidosis hereditaria por transtiretina, una enfermedad rara. Y a finales de 2023, la Agencia Europea del Medicamento (EMA) daba el visto bueno para la comercialización de la primera terapia de edición genética CRISPR en la Unión Europea para tratar dos enfermedades graves de la sangre, la anemia falciforme y beta talasemia.
“La tecnología CRISPR ya no es un futuro, sino el presente. En apenas diez años de recorrido, hay casi 100 ensayos clínicos que están utilizando dicha tecnología para desarrollar tratamientos de terapia génica innovadora para tratar múltiples enfermedades congénitas”, afirma uno de los máximos expertos en nuestro país, Lluis Montoliu, investigador del Centro Nacional de Biotecnología (CNB) del Centro Superior de Investigaciones Científicas (CSIC).